IODINE
CLOCK REACTION
di
Davide Galbiati
 di Bonn (1857) e
di Berlino (1880) e chimico,
compì anche studi pionieristici di chimica
fisica.
di Bonn (1857) e
di Berlino (1880) e chimico,
compì anche studi pionieristici di chimica
fisica.
Ci sono 4 varianti di queste reazioni. Qui è descritta la variante con
perossido d’idrogeno.
Attenzione: l’acido
solforico a queste concentrazioni è molto corrosivo.
Reagenti SOL. A:
·
Soluzione
acido solforico (H2SO4),
10 mL (diluire circa 1.10 mL di acido solforico 98% in 10 mL di acqua
distillata)
·
Perossido
d’idrogeno 3%(H2O2),
10 mL
·
Acqua
distillata, 80 mL
Reagenti SOL. B:
·
Soluzione
di tiosolfato di sodio (Na2S2O3),
20 mL (sciogliere 0.05 g di soluto in 20 mL di acqua distillata).
Prodotto usato prima nella fotografia come fissante.
·
Soluzione
di ioduro di potassio (KI), 5 mL (sciogliere 2 g di soluto in 5 mL di
acqua distillata). Anche questo usato in fotografia.
·
Soluzione
concentrata di amido, 30 mL (due cucchiaini in 100 mL di acqua
distillata)
·
Acqua
distillata, 45 mL
Strumentazione:
·
Comune
vetreria da laboratorio
·
Fornello/piastra
Formare
la SOL. A con la soluzione di acido solforico, acqua distillata e
perossido d’idrogeno, poi
diluire fino a volume di 100 mL. La soluzione si scalda un
po’.
Formare la soluzione concentrata di amido sciogliendo 2 cucchiaini di
amido in 100 mL di acqua distillata. Scaldare la soluzione e farla
schiarire un po’. Se necessario filtrare.
Formare la SOL. B con la soluzione di
tiosolfato di sodio, ioduro di potassio e 30 mL di soluzione di amido
concentrata già preparata. Portare poi a volume di 100 mL.
Non avvengono reazioni apparenti.
Ora mischiare 50 mL di SOL. A con un ugual volume di SOL. B.
Dopo esattamente 9 s
la soluzione cambia repentinamente colore da trasparente a blu
profondo.
Ora diluire le soluzioni rimaste con altri 50 mL di acqua distillata
ciascuna e mischiarle. Dopo esattamente 18 s la soluzione cambia colore.
|
SOL.
A e SOL. B |
Conclusione:
Mischiando le soluzioni avvengono 4 reazioni:
H2O2 +
2I− +
2H+ →
I2 +
2H2O
Quando lo ioduro di potassio si scioglie, lo ione
ioduro reagisce con l’acqua ossigenata e con lo ione idrogeno
(H+) fornito dall’acido solforico.
Questa reazione è la più lenta.
2S2O32− +
I2 →
S4O62− +
2I−
 Appena lo iodio elementare si forma, prima che colori la
soluzione, esso viene ridotto nuovamente a ioduro dallo ione riducente
tiosolfato. Questo è il motivo per cui la soluzione non
scurisce subito. Inoltre questa reazione è più
veloce della prima, quindi, a maggior ragione, la soluzione non
scurisce per lo iodio elementare.
Appena lo iodio elementare si forma, prima che colori la
soluzione, esso viene ridotto nuovamente a ioduro dallo ione riducente
tiosolfato. Questo è il motivo per cui la soluzione non
scurisce subito. Inoltre questa reazione è più
veloce della prima, quindi, a maggior ragione, la soluzione non
scurisce per lo iodio elementare.
Quando il tiosolfato si consuma, poiché
è largamente in difetto, in soluzione rimangono iodio
elementare e ioni ioduro. Questi reagiscono formando lo ione triioduro.
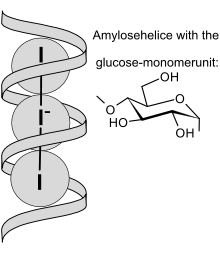
Lo ione triioduro reagisce con l’amilosio presente
nella salda d'amido, venendo incluso nella struttura ad elica con la
formazione di un complesso di colore blu-violaceo. I meccanismi chimici
per cui avviene la reazione, tuttavia, non sono ancora del tutto chiari.
Se
dimezziamo o raddoppiamo le quantità di un reagente oppure
del solvente, automaticamente si dimezzano o raddoppiano i tempi di reazione. Per
questo motivo le clock reactions
possono essere controllate. Nell’esperimento si noti che la
prima volta la reazione avviene dopo 9 s, la seconda dopo 18 s.
Varianti:
·
Variante
con iodato
·
Variante
con persolfato
· Variante con clorato

